|
||||
| ||||
|
Un giallo tra gli alambicchi? Argento (avvelenato!) Di Cricio
|
||||
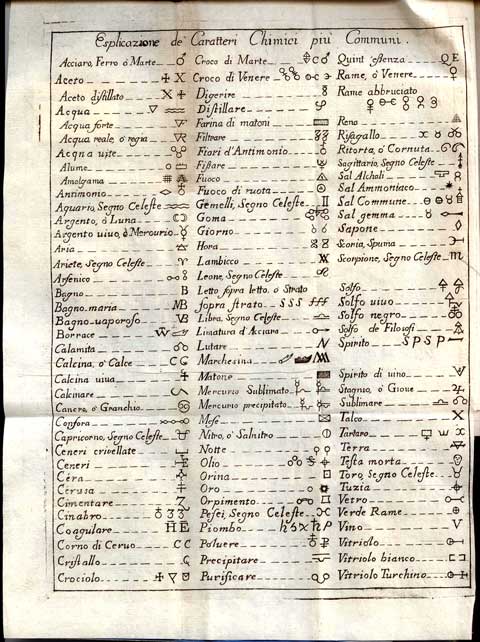
 Bello, lucido, brillante, segno di ricchezza, bellissimo per gioielli e vasellame... non è di questo argento che vi voglio parlare. C'è un altro argento, meno noto, ma non meno importante: il catalizzatore, preziosissimo per i chimici. Si, vi voglio parlare di una cosa accadutami come chimico. Qualcuno forse non sa che ho lavorato per ben 7 anni in un laboratorio di ricerche circa mezzo secolo fa ed ero molto appassionato al mio lavoro, tanto che ancora oggi lo ricordo con molto piacere. Bello, lucido, brillante, segno di ricchezza, bellissimo per gioielli e vasellame... non è di questo argento che vi voglio parlare. C'è un altro argento, meno noto, ma non meno importante: il catalizzatore, preziosissimo per i chimici. Si, vi voglio parlare di una cosa accadutami come chimico. Qualcuno forse non sa che ho lavorato per ben 7 anni in un laboratorio di ricerche circa mezzo secolo fa ed ero molto appassionato al mio lavoro, tanto che ancora oggi lo ricordo con molto piacere.
L'idea di raccontarvi questo mio aneddoto mi è venuta leggendo l'omonimo racconto di Primo Levi in “Il sistema periodico”, in cui il chimico-scrittore racconta di cosa può capitare, malgrado si cerchi di lavorare sempre nel modo più pulito possibile per evitare “avvelenamenti” dell'argento. Si, perché l'argento, per un chimico, può avvelenarsi e morire; ma passiamo a quello che mi successe con l'argento Avevo conquistato il laboratorio tutto mio. Da qualche tempo ero stato incaricato delle analisi dell'equipe di ricerca, analisi chimico-fisiche (gas cromatografia, IR) e dell'identificazione dei componenti ancora sconosciuti. Un lavoro interessante, ma anche con molte attività routinarie. Nei laboratori a fianco al mio, un gruppo di colleghi si dedicava invece a cercare di produrre nel migliore dei modi un composto strano: il perfluoroepossietilene, che poi chiameremo familiarmente “epossido”. La Dupont, il colosso americano nel campo dei composti fluorurati e inventrice del Teflon, aveva brevettato un modo per produrlo con le lampade ultraviolette. Alcuni colleghi seguivano quella strada; invece il Dr. Bergomi tentava un'altra via, quella della reazione catalitica, che sarebbe stata utile per produrre l'epossido con processi industriali. Per chi non sia chimico cerco di spiegare cosa vuol dire “processo catalitico” in modo sintetico: i componenti messi a contatto da soli non reagiscono o reagiscono lentamente, ma se è presente un “catalizzatore”, cioè un terzo prodotto che non viene consumato, la reazione diventa veloce. Poveretto, il dott. Bergomi tentava in tutti i modi, il gruppo di esperti in catalizzatori gli forniva argento in tutte le salse, depositato su palline di corindone, spugnoso, con vanadio o palladio, e così via, ma nulla, non succedeva proprio nulla. Un giorno gli dissi: “Ma sai che mi sembra sbagliato usare l'argento metallico come catalizzatore, credo che si dovrebbe usare l'ossido d'argento.” Bergomi strabuzzò gli occhi e scantonò “Ai catalizzatori devono pensarci quelli della sezione catalizzatori”. Lasciai perdere l'argomento, ma continuavo a pensarci: perché usare l'argento metallico? Ne parlai con il Capo equipe, un dottore (da noi non c'erano ancora professori) alto, magro, proveniente da Venezia, chiamato “fischio” perché quando era emozionato emetteva un fischio mentre parlava. Alla mia esposizione emise un lungo fischio e disse: “Ti dò quattro prove per dimostrare che hai ragione”. Fissammo quattro condizioni di reazione (temperatura, tempo di contatto e temperatura) in modo da scandire sommariamente l'area in cui la reazione avrebbe trovato le condizioni termodinamiche per avvenire. 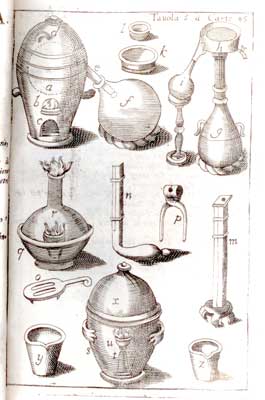 Mi misi al lavoro, senza intralciare o dimenticare i miei compiti istituzionali di analista. Mi misi al lavoro, senza intralciare o dimenticare i miei compiti istituzionali di analista.
Per prima cosa dovevo preparare l'ossido d'argento. Partivo dal nitrato e precipitavo l'ossido con idrato di sodio, la cosiddetta soda caustica, il tutto in un bel pallone di vetro e sul fondo del pallone si depositava una poltiglia bruna, l'ossido appunto. La separavo, la lavavo ben bene e poi dovevo trasformare la poltiglia in piccole pastiglie dure da mettere nel reattore. Per fare questo mi ero ingegnato con un tubo di vetro e una bacchetta di vetro. Riempivo il tubo a metà con la poltiglia di ossido d'argento e la comprimevo con la bacchetta; per evitare che l'ossido risalisse lungo l'asta di vetro, mettevo sul fondo della bacchetta un poco di nastro isolante che facesse da premistoppa. Un sistema rudimentale ma efficace. Le prime tre prove diedero risultati negativi o quasi, del tutto simili a quelli ottenuto dal dott. Bergomi, ma la quarta dimostrò a tutti inequivocabilmente che avevo avuto buon naso: conversione attorno al 40% e resa superiore al 90%, un risultato certamente insperato e entusiasmante. Ora si trattava di effettuare tutte le prove per arrivare a brevettare il processo. Quel compito venne affidato al dott. Bergomi, non era infatti mio compito quello e le specializzazioni si devono rispettare. A me restò l'incarico di preparare il catalizzatore. Tutto procedette bene per qualche mese, quando un giorno “fischio” entrò d'impeto nel mio laboratorio con il lungo camice bianco svolazzante, preceduto da un fischio acuto esclamò: “Cosa è successo? Il catalizzatore non funziona più!” Provai a ripassare tutti gli step nella preparazione, feci analizzare i prodotti, provai e riprovai producendo qualche etto di catalizzatore in tutti modi, ma niente da fare: tutto sembrava normale, ma l'argento non funzionava più: era avvelenato e quindi morto come catalizzatore. Ero passato dall'esaltazione della scoprta allo sconforto dell'insuccesso. Il mio cervello continuava a ripassare uno ad uno tutto quello che veniva fatto, specialmente di notte, e... una visione: fino ad allora avevamo usato nastro adesivo nero, ora era arancione. Verificai appena possibile con le bolle di prelievo: quel giorno in cui il catalizzatore era morto, al magazzino mi avevano dato un rotolo di nastro di un bel colore arancione, sicuramente le colpa era del colorante che avvelenava il catalizzatore. Al mattino cercai del nastro nero e preparai ancora una piccola quantità di ossido d'argento, lo passai a Bergomi, che mi guardava in modo scettico. Gli dissi “Vedrai che questo va!”. Non ne ero sicuro, ma dovevo convincerlo. Ed ancora ebbi ragione. Trovata la causa, risolto il problema. La gran quantità di catalizzatore avvelenato venne recuperato con una ossidazione con ozono per distruggere quelle infinitesime tracce di veleno; bonificato, venne usato per produrre l'epossido in quantità semindustriale; sarebbe servito ai polimerari per cercare di trasformarlo in gomma. Doveva essere una gomma molto resistente alla corrosione e alla temperatura, se ci si riusciva sarebbe stata una gran scoperta. Ne avevamo trovato un piccolo quantitativo formatosi naturalmente e l'obiettivo era riuscire a trovare un processo per produrla, cosa che purtroppo non si riuscì a fare. Ma la mia soddisfazione personale e il brevetto ci fu e battemmo di tante lunghezze il colosso americano. Penso di avervi annoiato abbastanza, ma perché vi ho voluto raccontare questo? Leggendo il racconto di Primo Levi ho notato la grande somiglianza del problema, quindi mi sembrava giusto testimoniare ai non chimici increduli, come la cosa fosse assolutamente vera, scientificamente provata, perché in tempi e luoghi diversi, con persone diverse, si è verificato l'identico problema. Ma c'è qualcosa di più; spesso si sentono fare affermazioni troppo ottimistiche sulla certezza della scienza, specialmente da chi di scienza ne capisce poco, come i letterati. Invece la scienza è piena di incertezze, le verità scientifiche sono dimostrate solo nel piccolo ambito in cui sono state sperimentate. La scienza procede ed avanza nella conoscenza sempre tra moltissimi errori ed il “metodo scientifico” ha proprio lo scopo di trovarli ed eliminarli, ma gli errori restano sempre perché sono infiniti. Infine ho voluto dare uno immagine di come si lavori in un laboratorio ricerche, dove la conoscenza è alla base del lavoro, ma che risulta inutile se non è accompagnata dalla attenzione a tutto, dalla curiosità per quello che avviene, dall'intuizione, e per che no, anche da un po' di culo!
Argomenti: #racconto , #scienza Leggi tutti gli articoli di Cricio (n° articoli 131) il caricamento della pagina potrebbe impiegare tempo |
||||
|
© Riproduzione vietata, anche parziale, di tutto il materiale pubblicato Articoli letti 15.908.166 seguici RSS Il sito utilizza cockies solo a fini statistici, non per profilazione. Parti terze potrebero usare cockeis di profilazione | ||||